
针对2019年冠状病毒病(COVID-19)的mRNA疫苗取得的非凡成功重新燃起了人们对mRNA作为递送治疗性蛋白质的手段的兴趣。然而,在将mRNA推广为一般治疗方式之前,仍有一系列挑战有待解决。一系列新技术可能克服这些挑战,包括优化mRNA货物的方法、具有固有组织嗜性的脂质载体和体内经皮递送系统。这些进展的整合可能会开启生物靶向mRNA疗法的前景,超越疫苗和其他免疫刺激剂,用于治疗多种临床适应症。近日,卡罗林斯卡学院的Kenneth R. Chien教授团队在Nature Biotechnology杂志上发表综述,对mRNA治疗应用开发的前景与挑战进行了概述。

两种COVID-19 mRNA疫苗的快速设计和开发标志着一种新的生物技术平台的出现,该平台可用于针对严重急性呼吸综合征冠状病毒2(SARS-CoV-2)以及可能针对多种微生物病原体和癌症进行免疫。从靶点鉴定到1期临床研究的时间非常短——以及mRNA疫苗在数十亿剂给药后令人信服的安全性——强调了新一代mRNA疗法的潜力,它超越了疫苗和其他依赖于用于刺激免疫反应的mRNA和脂质纳米颗粒(LNP)。
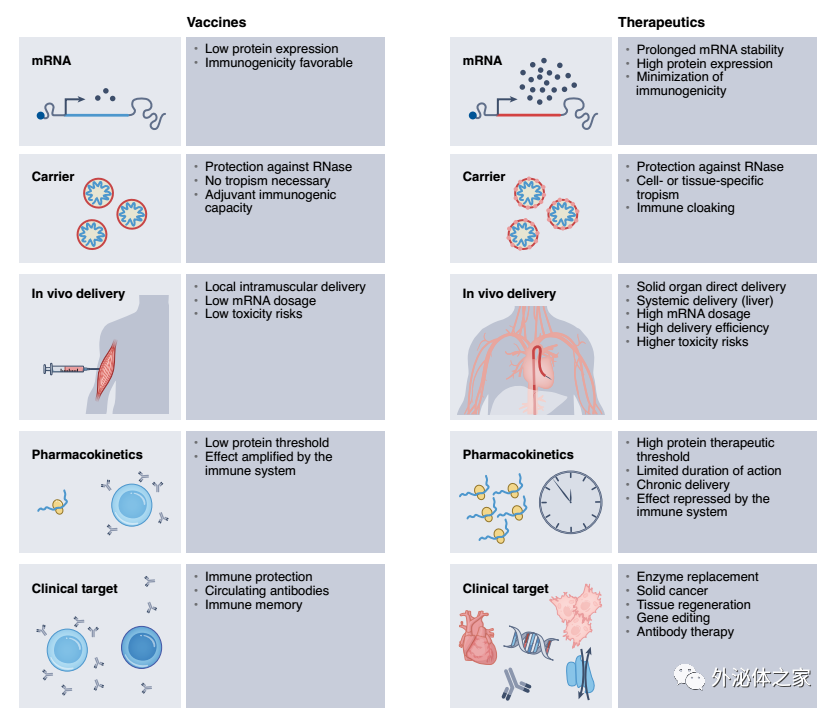
开发mRNA疫苗与治疗剂的比较路线图
与mRNA疫苗相比,开发mRNA疗法的途径提出了额外的挑战。免疫只需要产生最少量的蛋白质,因为免疫系统可以通过细胞介导和抗体介导的免疫显著放大抗原信号。相比之下,mRNA疗法需要高达1,000倍的蛋白质水平才能达到治疗阈值。在许多情况下,mRNA疗法必需靶向特定的细胞、组织或器官。这一要求更加重视靶细胞的摄取效率,这决定了表达的持续时间和水平。基于脂质的载体递送至感兴趣组织的组织生物利用度、循环半衰期和效率可以是严格的速率限制。除了很容易通过静脉内(i.v.)递送靶向的肝脏之外,向实体器官的有效递送仍然具有挑战性。另一个主要障碍是重复给药,这在慢性病的治疗中通常是必需的。即使经过优化的mRNA化学修饰和先进的LNP,长期给药最终也会激活先天免疫,同时降低治疗性蛋白表达。尽管存在这些挑战,许多新兴技术仍在开发中,以系统地解决这些问题。
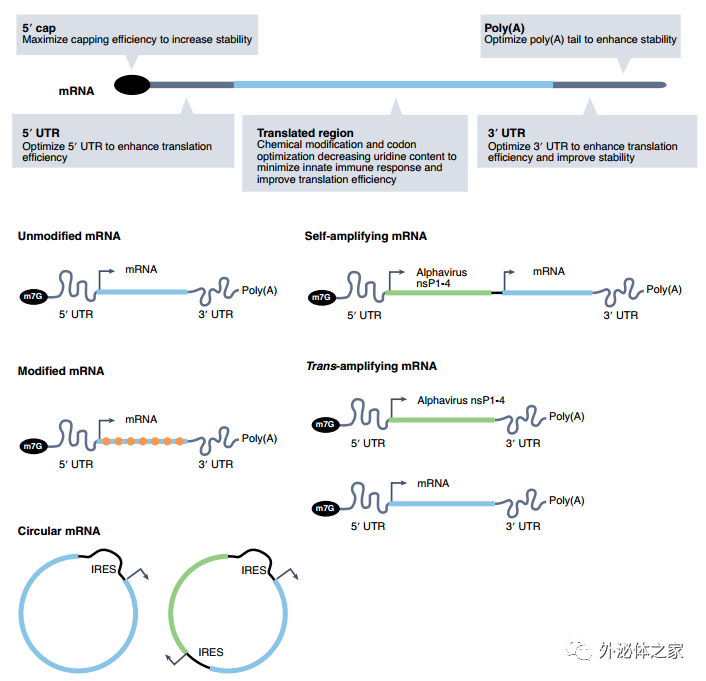
修饰mRNA以提高蛋白质表达效率
这篇综述调查了这些最有前途的新技术。
1. 第一部分讨论了设计和纯化mRNA货物以提高体内蛋白质生产的持续时间和幅度的方法。这些方法包括mRNA初级化学结构设计的改进、环状和自扩增mRNA的新形式以及改进的纯化策略。
2. 第二部分探索改进的mRNA包装系统以增强mRNA货物的递送,包括可电离的LNP、细胞和细胞外囊泡。
3. 第三部分讨论了将mRNA治疗靶向特定组织的新兴方法,例如用于输送到心脏、胰腺和肾脏的经皮导管,以及具有组织特异性趋向性的包装系统工程。
4. 第四部分考虑了允许重复给药以治疗慢性病的策略。
5.第五部分提供了mRNA治疗当前临床趋势的综合表格和总结。
6. 最后,第六部分考虑了mRNA治疗的范围以及这种新型治疗方式近期和长期临床开发的指导原则。
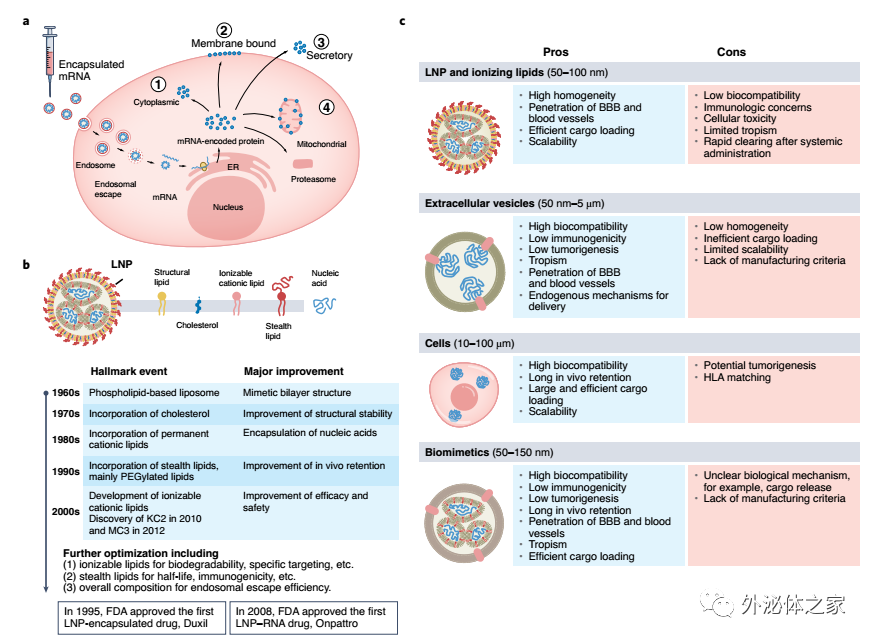
用于mRNA的模块化递送系统
a,mRNA细胞内递送和翻译成蛋白质的示意图。b,LNP的时间线开发和里程碑改进。c、各类先进载体的优缺点。
mRNA固有的不稳定性需要一个包装/递送系统来保护它免受核酸酶的降解,并允许有效的细胞摄取、细胞内释放和翻译成蛋白质。大多数正在开发的mRNA疗法依赖于LNP,最初在60多年前被报道。此后,LNP经历了许多改变和进步,最终在临床上首次用于递送小干扰RNA(siRNA)。同时,基于细胞、细胞外囊泡和仿生囊泡的包装系统正在开发中,并在临床前研究中作为替代方法进行验证。
细胞外囊泡(EV)包含由大多数细胞类型产生的一组异质的细胞外双层膜囊泡。EV的特征和生物起源已在很多综述总结过(Science最新综述:外泌体的生物学、功能和生物医学应用;【NCB】Théry大牛的最新细胞外囊泡综述)。在哺乳动物中,根据其大小和细胞内起源,存在三种主要类型的EV。外泌体(50-150 nm)是研究和表征最多的EV,通过内吞作用和胞吐作用在细胞之间穿梭和运送货物。在被受体细胞摄取后,外泌体由类似于LNP的内体加工。然而,外泌体在被溶酶体降解或穿梭于其他细胞之前,会在细胞内进行进一步的“分类”和“交换”处理。微泡(50-500 nm)通过质膜出芽(>1 μm)以低速率产生;凋亡小体是凋亡细胞的一个特定特征。
研究表明,EV在整个身体的同型和异型细胞间通讯中起着至关重要的作用。它们可以携带和运送各种货物,从代谢物、短核酸和氨基酸到全长mRNA和蛋白质。作为天然囊泡,EV在药物递送方面具有多种优势,例如生物相容性和低免疫原性。目前,EVs,特别是外泌体在肿瘤和心血管疾病的诊断、预后和治疗中的功能和应用正在深入探索,重点关注EVs的免疫调节和货物输送特性。
与基于细胞的递送系统类似,EV的细胞来源对其潜在应用至关重要。人们认为,EV可以“继承”其亲代细胞的特性。例如,源自血细胞的EV在全身给药后保留了其穿透血脑屏障(BBB)的能力。同样,源自MSC的EV具有相似的抗炎和旁分泌特性。此外,临床前研究表明,源自多种细胞类型的EV不会引起毒性,并且在重复给药后具有良好的耐受性。因此,EV不仅可以充当惰性递送工具,还可以设计用于特定的交付和重复给药。基本挑战围绕同质EV的表征、分离和纯化,因为典型的生物标志物仍需要识别和标准化。对不同的分离方法进行了全面检查。另一个挑战是EV的有效装载。策略通常包括通过传统方法(例如,电穿孔、超声处理、挤压或冻融循环)将货物直接与分离的EV一起后装载,或在EV分离之前将所需的货物预装载到亲代细胞中。
最近,已经报道了几种增强预加载特异性的方法,包括前向筛选和靶向工程。通过对参与EVs货物装载的部分进行系统筛选,确定了候选蛋白质部分,以便在体内进行有效的药物递送。通过使用含有抑制蛋白结构域的蛋白质1(ARRDC1)来识别感兴趣的mRNA或蛋白质(例如,p53或CRISPR-Cas9复合物),可以诱导AARDC1介导的微泡(ARMM)的特异性和有效负载,并成功地传递它们的货物体外和体内(拜耳/晨兴领投!哈佛大学细胞外囊泡递送技术,Vesigen公司A轮2850万美元)。
另一种预加载方法包括使用病毒衣壳基因的内源同源物在哺乳动物细胞中生成非典型EV,例如病毒样颗粒,这使得病毒样颗粒能够优先加载含有特定基序的mRNA。基于该技术,开发了选择性递送系统(SEND和eVLP),以在体外包装和递送特定的RNA,并在体外和体内递送CRISPR-Cas9(Science重磅:CRISPR先驱张锋教授团队发现全新RNA递送系统)。
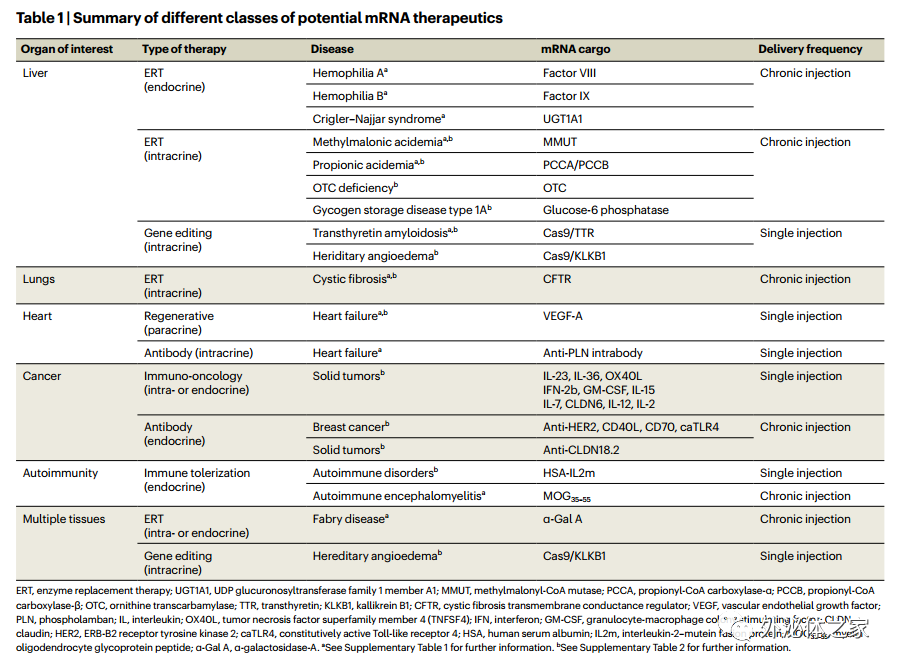
不同类别的潜在mRNA疗法总结
三十年的科学和临床进展,加上开发mRNA COVID-19疫苗的巨大努力,预示着mRNA疗法的未来是好兆头。如上所述,只需单击几下,即可以自动化、可扩展、无细胞的形式在临床级快速制备编码任何蛋白质的mRNA。在不久的将来,应该可以生成模块化、可扩展的良好生产规范(GMP)级制造单元,可以在任何GMP级设施中设置,从而无需冷链运输。在这方面,mRNA疗法的冻干即将到来,并将在很大程度上消除当前COVID-19 mRNA疫苗存在的存储问题。随着新的LNP和非LNP载体的开发具有改善的副作用特征和增加的容量,复杂的基因和碱基编辑以及重复给药可能变得可行,以促进酶替代疗法的新方法。
同时,从重组蛋白治疗的历史中回忆起一个警示故事是有益的。在该领域的早期,预计大多数生长因子将成为药物。在VEGF克隆30年后,它是否会成为一种具有临床价值的治疗药物还有待观察。因此,mRNA药物的未来可能取决于将这种“生命软件”与人类生理系统的生物“硬件”相匹配,以提高精度、延长持续时间以及具有可耐受的安全性的长期给药选项。未来几年,mRNA货物、细胞内载体和体内递送系统的快速发展,再加上对生物学和临床的深入了解,将为许多临床需求未得到满足而其他治疗方法无法轻易解决的疾病患者带来新的希望。