
原创 墨竹 BiG生物创新社
前 言
2021年是位于德国伍珀塔尔的拜耳化学研究实验室成立125周年。许多著名的小分子药物,从阿司匹林到利伐沙班,都是从这个研究站涌现出来的。
小分子不断地使医学突破和解决医疗需求,拯救了无数人的生命。小分子在生物医学研究中作为化学探针起着至关重要的作用,有助于理解疾病生物学。在过去的一个世纪里,传统的小分子药物一直是药物研究的主导模式。然而,新的模式,如蛋白质水解靶向嵌合体(PROTAC)和RNA靶向小分子(RSM),以及生物学方法,如基于抗体的治疗以及细胞和基因治疗,已被添加到药物发现工具箱中。
小分子在未来的药物研究中将扮演什么角色?小分子将如何继续满足患者未来的需求?在这篇综述中,我们借此机会回顾和阐明一些小分子药物研究的历史基石,讨论药物发现的当前和未来趋势,并对药物研究的未来提出个人的展望,重点放在小分子药物研究上。

图1 1908年最初的拜耳化学研究实验室2号展厅
01 从阿司匹林到现在 几种著名小分子药物的历史回顾
纵观历史,许多小分子药物为医学进步和改善患者生活做出了贡献(图2)。其中一些早期药物至今仍在使用,部分药物已经从市场上消失,但在其特定适应症的改善治疗方面起到了重要作用。
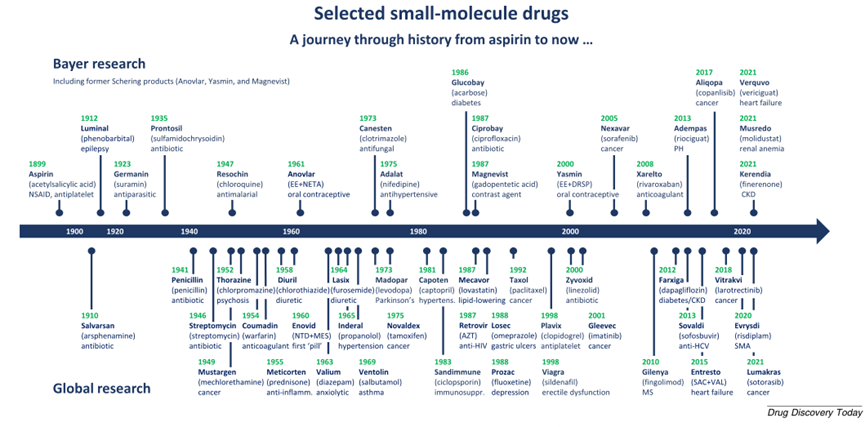
图2 从阿司匹林开始选定的小分子药物时间表,展示了小分子作为治疗药物的范围
1899年:Aspirin
1941年:Penicillin
1960年:Enovid, the first ‘pill’
1987年:Retrovir, the first anti-HIVdrug
2008年:Xarelto
2014年:Adempas
2018年:Vitrakvi
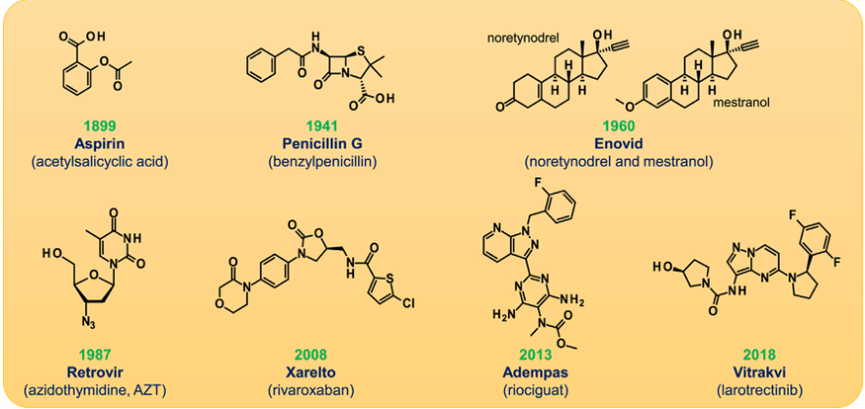
图3 小分子药物的化学结构
02 小分子在药物发现中 实现多种应用的独特性质
2.1 小分子的关键特性
小分子作为药物的成功归功于它们的固有特性,包括它们跨越生物屏障和调节一系列不同生物靶点的能力。口服生物利用度是大多数小分子药物的一个关键特征,可以作为片剂标准的口服给药。与生物制品相比,这种方便性是一个巨大的优势,即使药理效应的大小可能是相似的。小分子的另一个重要特征是它们的模块化结构以及通过化学合成容易获得。这允许化学结构的快速变化和系统地改善它们的性能。最后,小分子通常表现出很高的代谢稳定性,并且与大多数药物配方和给药途径兼容。下表总结了小分子的几个更关键的特性。
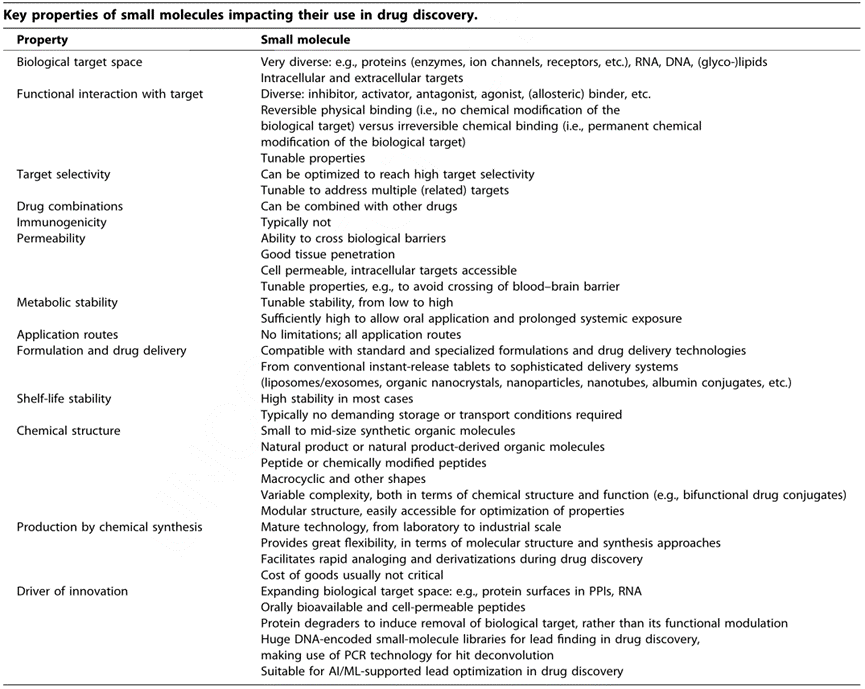
小分子不断扩展到新的作用模式,征服新的靶空间,扩大了药物发现的经典工具箱。新的化学模式和使用小分子的新方法已经出现,解决了以前被认为不可用药的生物目标。
小分子可以通过分子间作用力(如氢键和范德华力)以非共价方式与生物靶标结合,也可以参与共价键永久性地修饰靶标,以及介于两者之间。共价药物的早期例子包括阿司匹林和青霉素。乙酰水杨酸通过将乙酰基转移到活性位点丝氨酸残基来共价修饰环加氧酶,青霉素通过β-内酰胺开环机制与青霉素结合蛋白的丝氨酸残基共价结合。虽然这些早期例子的共价结合模式是基于偶然发现的,并且只是在回顾中才被揭示,但靶向共价抑制(TCI)最近已经成为一种越来越相关的方法。长期以来,KRAS蛋白一直被认为是难成药的靶点。共价抑制剂通过与仅以突变形式存在的半胱氨酸残基结合来成功解决。
蛋白质之间的相互作用在许多细胞过程中都是必不可少的,蛋白质-蛋白质相互作用(PPI)的稳定和破坏构成了治疗干预的诱人靶点。虽然基于抗体的PPI调节剂在已知治疗实体的数量上占据主导地位,但由于上述原因,小分子药物正日益受到关注,即它们具有良好的口服生物利用度、更好的组织渗透性、较低的免疫原性风险和较低的研发成本。考虑到蛋白质大的结合表面积,小分子的尺寸较小,有效的小分子PPI调节剂的设计比小分子酶或受体结合剂更具挑战性。在这方面,一个有趣的方法是通过环肽杂交分子稳定蛋白质结合基序,例如a-螺旋(图4)。
虽然大多数药物靶点是蛋白质,但RNA靶向小分子(RTSMs)正在成为一种新的治疗方式。在很长一段时间里,RNA被认为是不可用药的,因为人们感觉到缺乏合适的结合位点。现在已经知道,尽管RNA比蛋白质更具反射性,但它可以呈现离散的二级和三级结构,这些结构为小分子相互作用创造了结合位点。直到2020年,第一种人类RTSM药物Evrysdi(risdiplam)才被推向市场,用于治疗脊髓性肌萎缩症(SMA)(图4)。
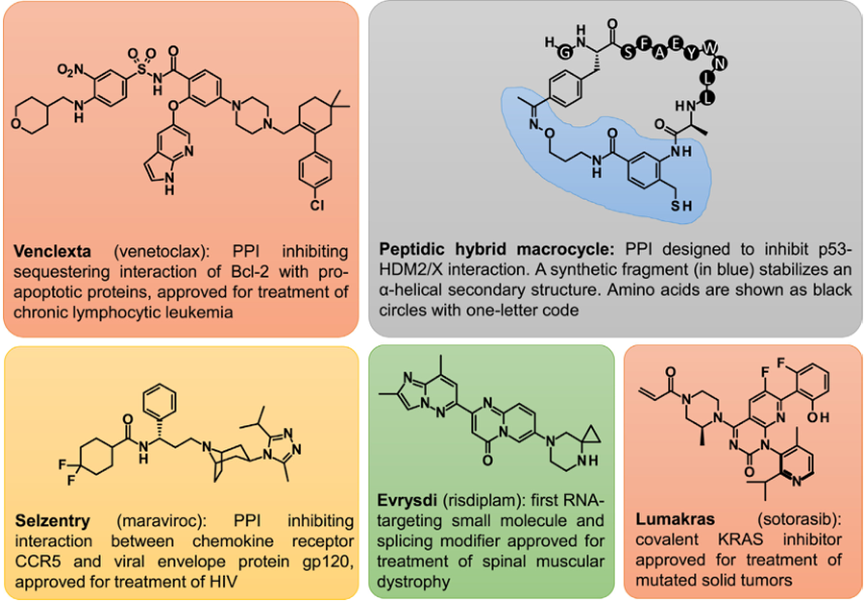
图4 成功拓展小分子生物靶标空间的例子
一种小分子药物偶联物,包括共价连接到具有不同生物功能的第二分子部分的小分子。一个分子部分的任务是将偶联物引导到预期的作用位点,以便另一个分子部分能够高度特异性地发挥其药理活性。抗体-药物偶联物(ADC)是使用高选择性抗体将结合物定向到靶部位的突出例子。在ADC内化和小分子从抗体的细胞内裂解后,以微环境特异性的方式产生高局部浓度的药理活性小分子。局部浓度的提高提供了降低全身药物浓度的机会,从而导致副作用的总体改善。到目前为止,已有14款ADC药物被批准用于治疗血液和实体肿瘤。第一种是Mylotarg(Getuzumab Ozogamicin),它最初于2000年推出,紧随其后的是Adcetris(Brentuximab Vedotin)和Kadcyla(trastuzumab emtansine,图5)。
PROTAC是一种降解蛋白质的双功能药物结合物,含有两个相互共价连接的小分子部分:一个与目标蛋白结合,另一个与E3连接酶结合。E3连接酶将泛素转移到它们的天然蛋白底物上,从而标记它们的蛋白酶体降解。PROTAC分子通过与目的蛋白结合后将目的蛋白与E3连接酶进行拉拢,使得E3可以泛素化标记目的蛋白,被泛素化的目的蛋白可以通过蛋白酶体途径降解掉,即使它不是所利用的连接酶的天然底物。因此,蛋白质可以被细胞蛋白酶体降解,将其从细胞中移除,而不仅仅是调节其功能。由于其分子结构是双功能分子,PROTAC比传统的小分子要大,这对口服生物利用度和细胞渗透性构成了潜在的挑战。此外,优化是复杂的,因为并不是每个PROTAC分子都能与目标蛋白和E3连接酶实现有效的相互作用。尽管存在这些障碍,第一批PROTAC已经成功地转移到了诊所。2019年,ARV-110和ARV-471进入癌症适应症临床试验(图5)。
分子胶是单功能的,因此通常比PROTAC小,并且具有相当传统的小分子特性。被批准的分子胶是沙利度胺及其衍生物,其作用方式是在回顾中才发现的。
溶酶体靶向嵌合体(LYTAC)以PROTAC和分子胶不能解决的膜和细胞外蛋白为靶标。LYTAC于2020年首次被报道,并将溶酶体途径用于蛋白质降解作为未来潜在应用的一种有趣的方法。
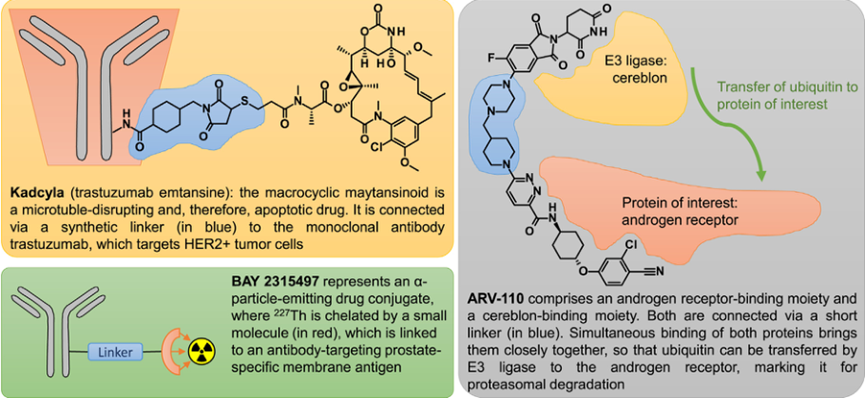
图5 双功能小分子偶联物的例子
治疗性多肽通常表现出对其靶点的高效力和高选择性。然而,它们的治疗应用通常受到口服生物利用度低、血浆稳定性低和膜通透性低的阻碍。包括添加小分子渗透促进剂和几种化学修饰技术可以解决这些缺点。一个关键的策略是通过设计环状、装订、缝合或其他受限制的多肽来稳定多肽,这些多肽可以改善药代动力学和组织/细胞穿透特性。在许多情况下,肽中包含了小分子型结构特征。同样,肽与聚乙二醇或脂肪酸的偶联可以延长其半衰期,而不会影响其效力。第一个口服生物利用肽Rybelsus(口服半胱氨酸)于2019年被批准用于治疗2型糖尿病。
小分子可作为科学工具在分子水平上阐明病理或生理机制,并识别或验证药物靶点。这一跨学科的药物研究领域被称为“化学生物学”,在过去的25年里已经相当成熟,建立在化学、生物学、生理学和医学的交叉点上。用作化学探针的小分子与用作药物的小分子没有本质上的区别,但它们通常不需要在体内药效或体内药代动力学等特性方面进行充分优化。根据它们的特殊用途,它们也可以在分离过程中被标记以进行鉴定或富集,或者可以用额外的官能团进行修饰以进行共价结合(例如,在化学蛋白质组学研究中)。值得注意的是,在开放科学倡议的支持下,科学界正在产生越来越多的化学探针,如EubOpen和结构基因组联合会(SGC),以及学术界和工业界的合作伙伴。全球开放科学运动目标2035旨在确定整个人类基因组的探针,从而促进发现治疗人类疾病的新药。
在细胞治疗中,小分子添加剂可以在细胞扩增、冷冻保存和配制过程中保证产品质量,并可以改善毒理学特征,提高干预的治疗效果。
在基因治疗中,根据不同的作用模式,已经开发了广泛的小分子来提高治疗效果。应用于体外或体内转基因细胞的载体提供了许多机会,但时机和精确度是有效性和安全性的关键。小分子在基因治疗中的重要应用是增强载体的内在化,靶向参与转导的细胞内通路,以及阻断细胞抗病毒通路。转导是一个复杂的过程,目前还不完全清楚;因此,表型筛选仍然是鉴定化学物质的首选方法。
一种非治疗性但临床上高度相关的应用是使用小分子作为诊断剂。小分子被广泛用于成像目的,如正电子发射断层扫描(PET)示踪剂、X射线、磁共振成像(MRI)、超声波和近红外造影剂。小分子可以扮演的角色的多样性反映了应用本身的多样性。
数字化和人工智能(AI)正在给所有行业带来革命性的变化,同样也开始改变药物发现部门。小分子特别适合于机器学习(ML)方法。一方面,这是因为它们的模块化化学结构,可以翻译成机器可读的格式。另一方面,大量历史上增长的合成方法、物理化学特性和蛋白质-靶相互作用的数据集是广泛可用的。挑战和艺术是通过进一步开发计算工具、利用复合数据和无缝整合高效的数字工作流程来“整合一切”,以支持药物化学家为患者发明新的治疗药物。
结束语和展望
120多年来,新型小分子药物不仅对人类个体的预期寿命和生活质量产生了积极影响,而且在全球范围内对社会产生了影响。
制药行业的目标是采用多种方式来应对人类疾病,包括小分子、抗体、核酸、聚糖以及细胞和基因治疗等。考虑到特定疾病背景下的利弊,优先以患者为中心。然而,对于许多疾病,小分子通常仍然是选择的方式。
除了小分子的内在优势(例如灵活的作用模式和适应性的给药途径),还可以通过与其他药物的联合治疗,从而增加了临床效果。小分子的保质期通常较长,这使得这种方式比任何其他方式能够以高度可持续的医疗保健系统方式接触到更多有需要的患者。小分子非常适合解决未满足的医疗需求。预计它们将继续推动未来药物研究的创新,从而继续改善患者的生活。