
RNA在人类生物学和疾病功能障碍中发挥不同的功能作用。靶向RNA的治疗策略包括反义寡核苷酸(ASOs)、CRISPR基因编辑和识别RNA结构的小分子。小分子是一种具有口服生物利用度和血脑屏障渗透的重要替代方案,且可以系统地优化物理化学性质,以提高药代动力学和效力。
现有的RNA靶向小分子使用一系列机制,包括通过与细胞蛋白作为分子胶实现定向剪接,抑制不可药物蛋白的翻译和非编码RNA中的功能结构失活。最近发表在Nature Reviews Drug Discovery上的综述“Targeting RNA structures with small molecules”概述了识别、验证和优化靶向功能转录组的小分子研发策略及其未来展望。
如何定义小分子靶向的RNA结构?
1.1 确定RNA结构
准确的RNA结构模型是设计或发现调节其功能的小分子的关键。计算模拟方法可以从序列模拟RNA结构。生物物理方法,如核磁共振波谱、X射线晶体学和低温电子显微镜也被广泛用于确定RNA结构。
1.2 评估RNA结构预测的准确性
必须通过统计能力和严谨的视角来看待预测的结构,并通过深入剖析其生物学功能来加以调整。
1.3 定义转录组中的功能RNA结构
从5‘端到3’端和从非翻译区到ORF的转录本,可以发现功能性RNA结构(图1)。功能结构可以通过计算或实验使用ASO,空间阻断功能结构或通过突变分析来识别。已被小分子有效靶向的RNA结构(结合产生下游的生物反应)参与生物分子与蛋白质的相互作用中,包括核糖体,其他的RNA和DNA。
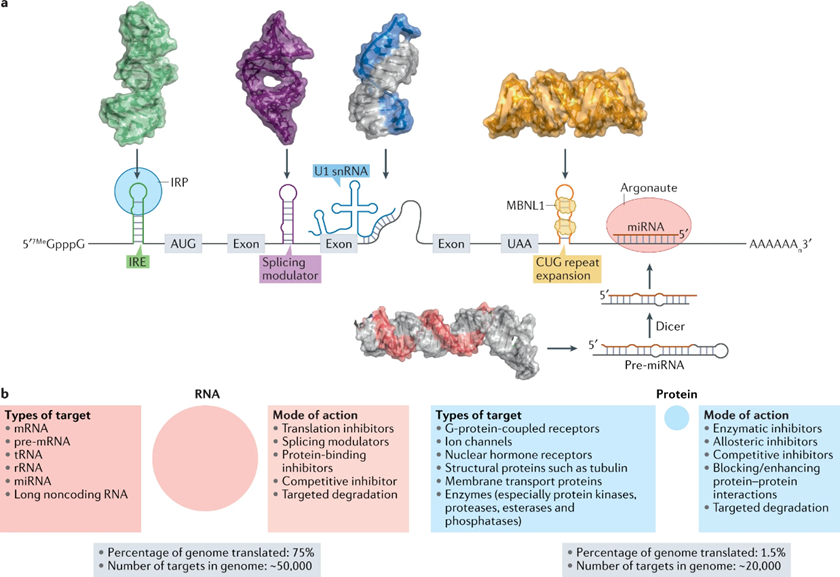
图1:人类RNA调节关键的生物过程,其功能由其结构驱动
1.4 影响小分子靶向RNA选择性的因素
一个小分子对其结合RNA存在结合选择性和功能选择性,影响因素包括转录组结构的独特性和小分子与RNA的相对亲和力。小分子可以在转录组和蛋白质组中发挥选择性作用,但与RNA结合的支架似乎与蛋白质结合的支架不同。
1.5 结合RNA的小分子之间的共性
与RNA结合的小分子将具有独特的性质,且不一定符合传统的药物开发五项准则。各种研究已经确定了具有对RNA亲和力的特殊支架和化学构型,如indole、2-苯林多尔、2-苯基苯并咪唑、2-苯基咪唑、甲基嘧啶-2、4-二胺等。
如何识别“小分子-RNA结合物”?
2.1 以RNA为中心的方法
▲亲和质谱法(AS-MS)是一种无标记的方法,可以从未结合的配体分离后,通过质谱直接鉴定目标配体复合物。其变体,自动配体识别系统(ALIS),通过分离形成的复合物来间接检测目标-配体的相互作用以识别结合的配体(图2a)。
▲基于荧光的分析。另一种高通量的分析方法依赖于一种荧光染料或化合物被一个带标签的小分子取代,如TO-PRO-1,荧光模拟物2-氨基嘌呤(2-AP)和FRET分析(图2b)。
▲基于微阵列的筛选。小分子微阵列(SMMs)是通过在空间阵列中将少量化合物传递到玻片中创建的,已被用于筛选多种化合物和RNA靶点(图2c)。
▲基于片段的配体发现利用低分子量化合物库来有效地探索可能结合感兴趣的靶RNA的化学空间(图2d)。
▲DNA编码化合物库(DEL)技术是一种探索在溶液或固相中结合目标生物分子的化学空间的强大方法。化合物功能化珠的筛选通常与荧光标记的靶标结合,通常存在不同标记的脱靶标(图2e)。
2.2 设计小分子RNA结合剂
▲基于结构的设计和对接。蛋白质设计和对接首先是基于结构的蛋白质靶标,使RNA靶标的先导化合物的发现和优化成为可能(图2g)。
▲表型筛选。表型筛选是一种识别影响与特定表型相关的途径的化合物的策略,因此不需要了解MOA或靶点。
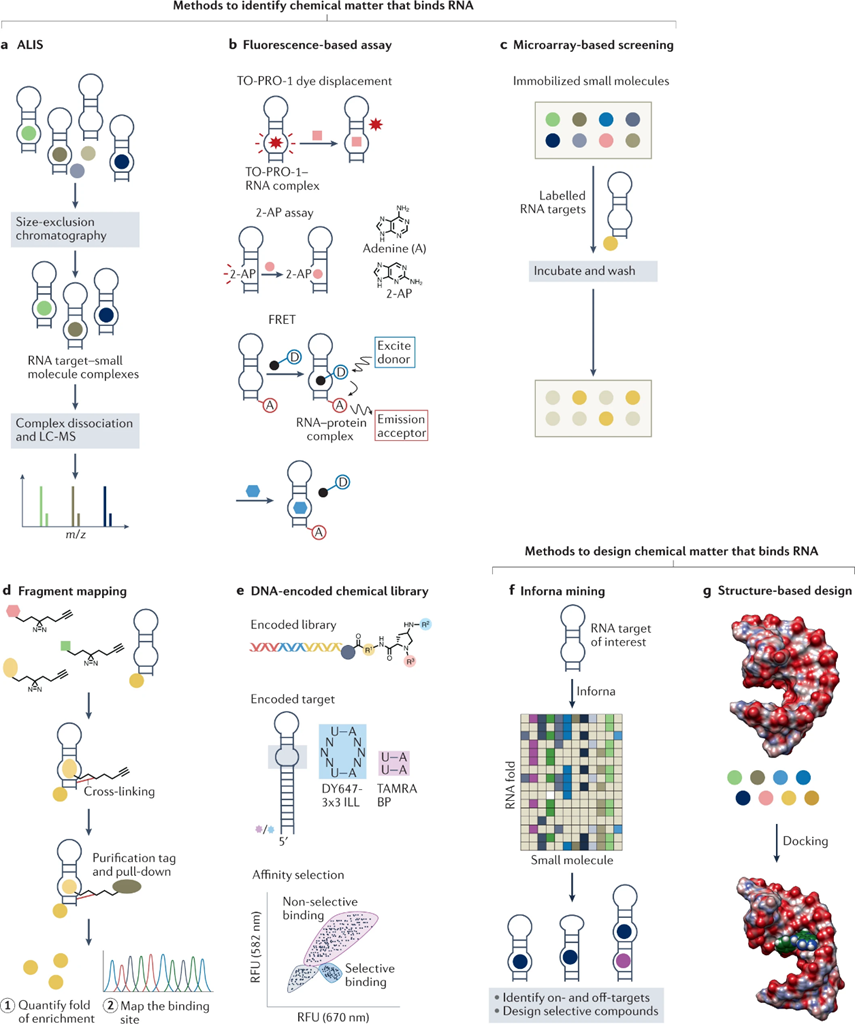
图2:识别或设计小分子 RNA 结合剂的方法
小分子靶向RNA的靶标验证和选择性
3.1 耐药性分析
对耐药菌株的基因组进行测序,以确定哪些基因发生了突变,从而确定该化合物的靶RNA(图3a)。这种方法被用来验证核糖体、玫瑰黄素和嘧啶硫胺素的核糖体开关靶点(表1)。
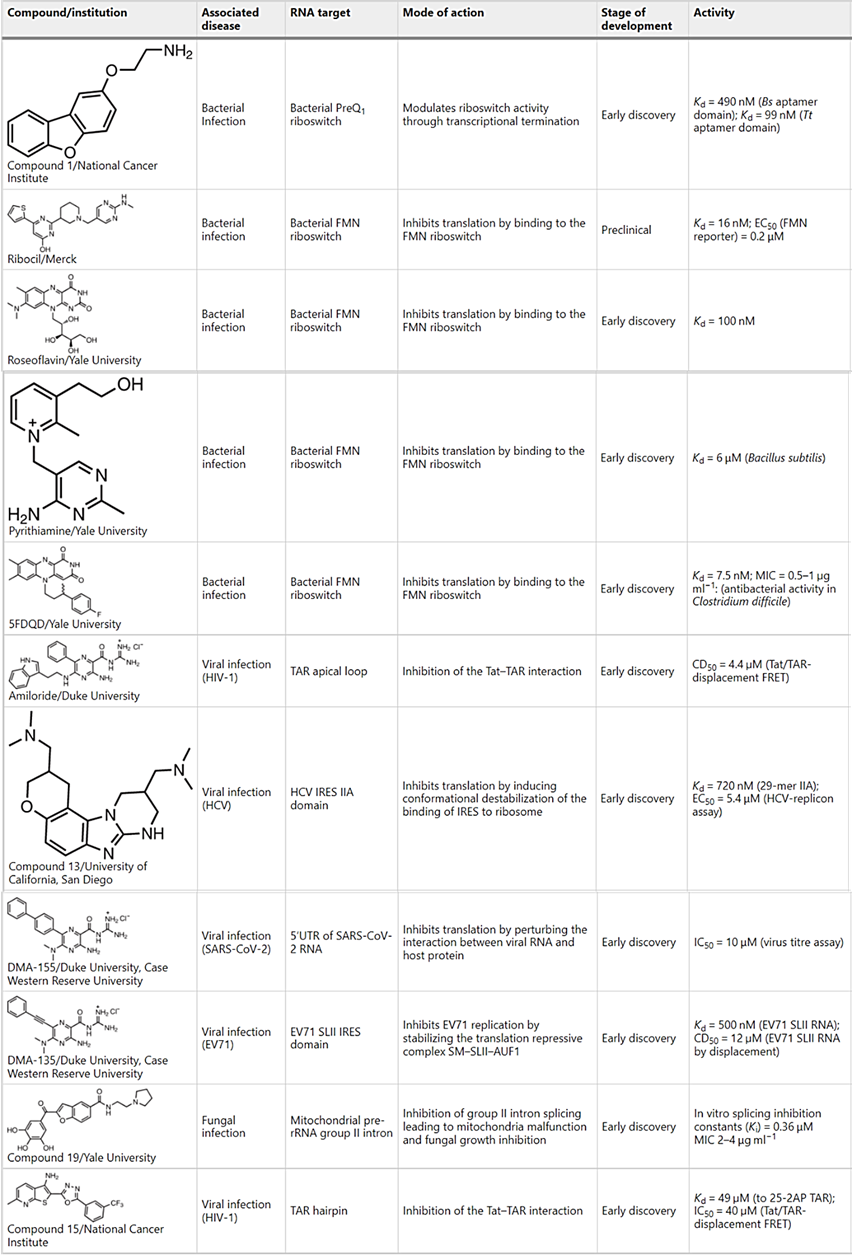
表 1:与传染病相关的 RNA 结合的小分子示例
3.2 共价键的形成来测量小分子与靶RNA的直接接触
RNA的细胞靶标验证方法基于共价键形成或切割靶标。化学交联和下拉分离(Chem-CLIP;图3b)依赖于小分子的功能修饰。通过交联将动态可逆结合转化为共价键,并通过下拉富集放大信号。竞争化学CLIP(C-Chem-CLIP),定义了先导化合物的靶RNA,可用于筛选其他与同一RNA靶标结合的分子,从而生成构效关系(SAR)。
3.3 靶RNA切割以评估结合占用率
细胞靶点验证依赖于RNA靶点的竞争性切割,包括ASO-Bind-Map(图3c)和与RNA降解物的竞争(图3d)。
3.4 量化选择性
量化化合物在整个转录组中的影响主要是通过确定与靶点直接结合和在转录组和蛋白质组水平的通路分析。量化小分子选择性的重要指标是小分子的基尼系数。
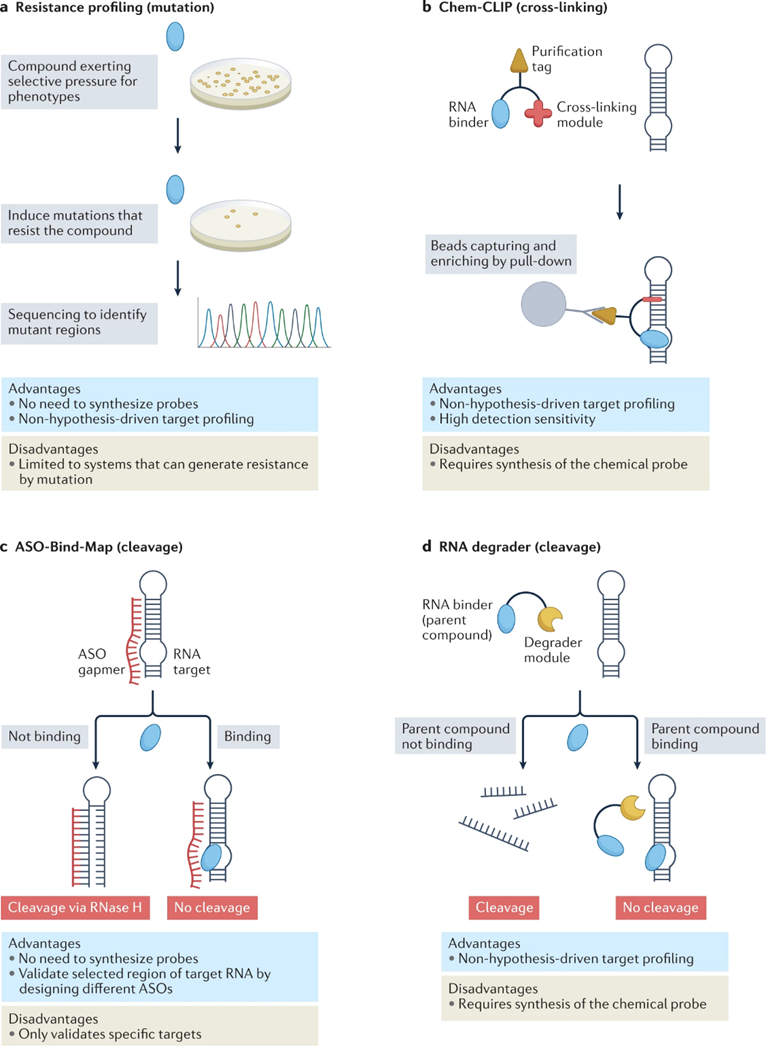
图3:针对 RNA 的小分子的靶点验证方法
小分子靶向RNA的先导化合物优化
4.1 传统的药物化学方法。
传统的药物化学优化通常从模拟合成或购买开始,以建立hit化合物的构效关系(图4a)。
4.2 结构导向方法。
这种模型通常是由核磁共振波谱或x射线晶体学实验产生的。实验模型通常与分子动力学模拟相结合,生成结构集合,其中算法在实验确定的参数基础上模拟RNA构象(图4b)。
4.3 模块化装配方法。
模块化组装已被用于RNA重复扩展,且已显示出周期性的内环阵列(图4c)。
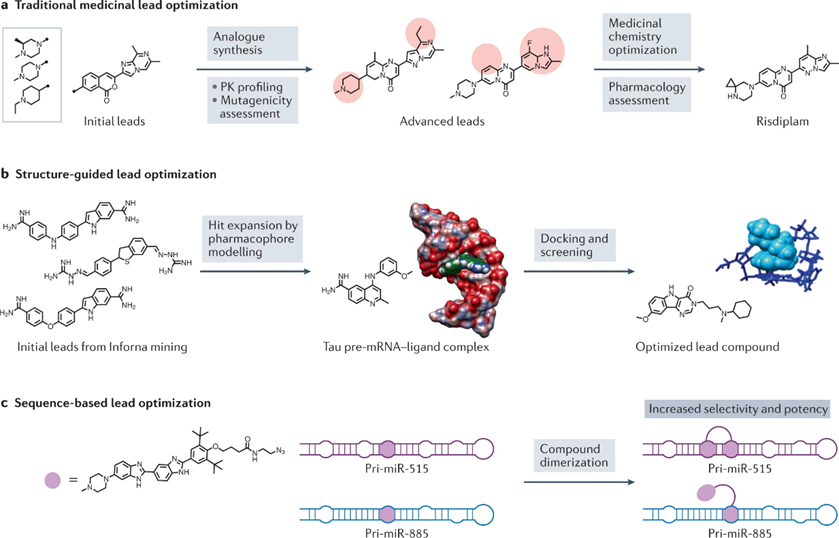
图4 :RNA 靶向小分子的先导优化策略
举例:小分子-RNA结合物
下面强调了几个小分子RNA结合物以精确和预测的方式扰乱下游生物学的几个例子。值得注意的是,小分子直接参与一个功能位点就足以发挥生物学效应(表1-3)。
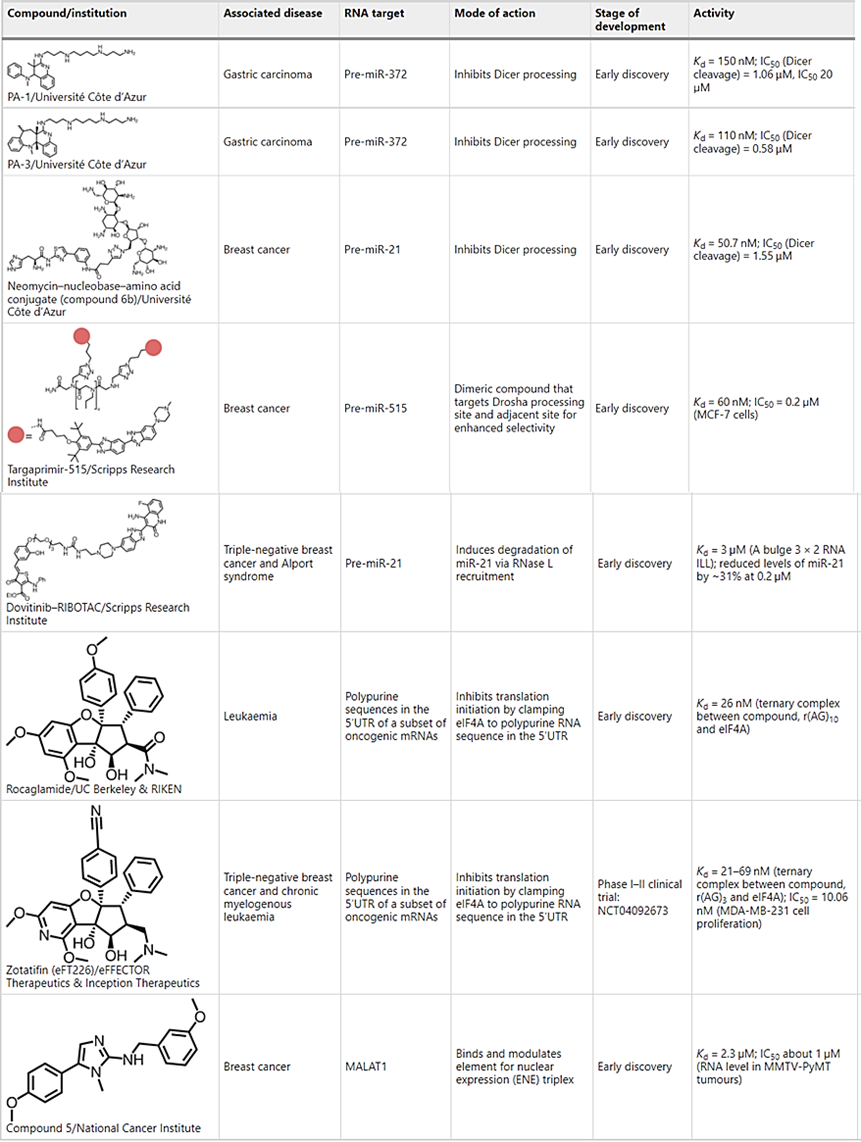
表 2:与癌症相关的 RNA 结合的小分子示例
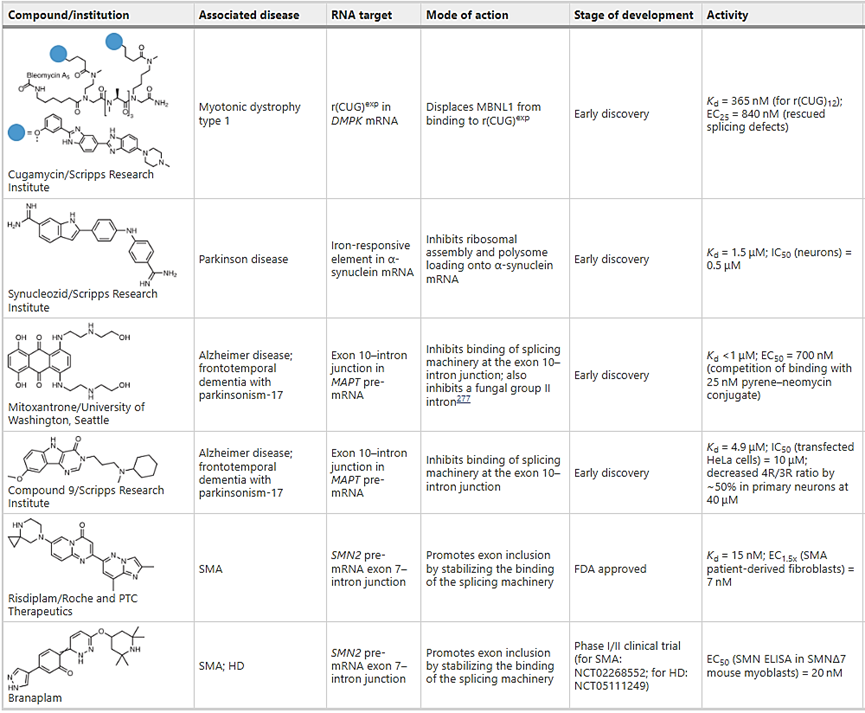
表 3:与涉及神经肌肉和神经退行性疾病的 RNA 结合的小分子示例
5.1 靶向功能性RNA结构
▲发现结合病毒RNA的小分子。第一个被干扰感染过程的小分子靶向的病毒调控元件是HIV TAR和RRE RNAs。结构引导的方法已被用于识别TAR RNA中抑制转录激活的TAR RNA的新骨架(表1)。
▲发现针对II组内含子的抗真菌药物。II组内含子是一类自剪接核酶,存在于真菌和酵母的线粒体中,但在哺乳动物中没有,这使它们可能成为开发抗真菌药物的理想靶点。
▲用小分子靶向人类miRNAs。miRNAs是20-25个核苷酸的小非编码RNA,是转录后基因调控的关键角色,miRNA前体中的Drosha或Dicer加工位点是可靶向的功能结构,可以缩短以缓解疾病(图5a和表2)。
▲通过靶向编码的RNA来抑制不可用药的蛋白质:α-突触核蛋白。当致病蛋白缺乏明确的结构时,通常被认为是不可用药的。给这些本质上紊乱的蛋白质(IDPs)注射药物的一种方法是通过靶向编码的mRNA来抑制它们的翻译。
▲通过小分子引导外显子排斥来改变蛋白的异构体:微管相关蛋白tau。对寡核苷酸的研究表明,可以通过结合并封闭剪接体机制中的突变来挽救剪接缺陷,这表明小分子也可以直接剪接(图5c和表3)。
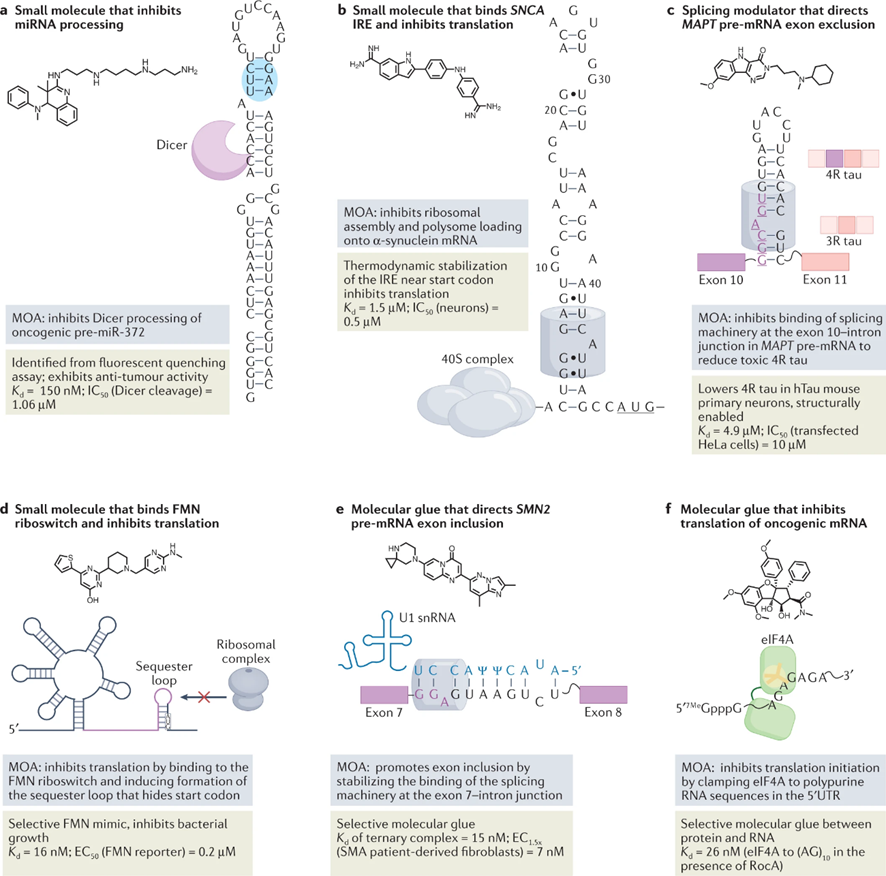
图5:小分子与 RNA 结构的结合通过各种作用模式引发生物学效应
5.2 靶向RNA结构进行降解
可以通过促进RNA的降解来调节RNA功能,包括依赖于化学诱导的靶标RNA的直接小分子切割或通过核酸酶招募实现的靶标降解(图6)。
▲核酸酶招募来切割RNA靶点:核糖核酸核酸靶向嵌合体(RIBOTACs)已经被开发用于靶向降解RNA,由RNA结合模块和RNase招募模块组成,选择性地介导RNA衰减(图6a)。
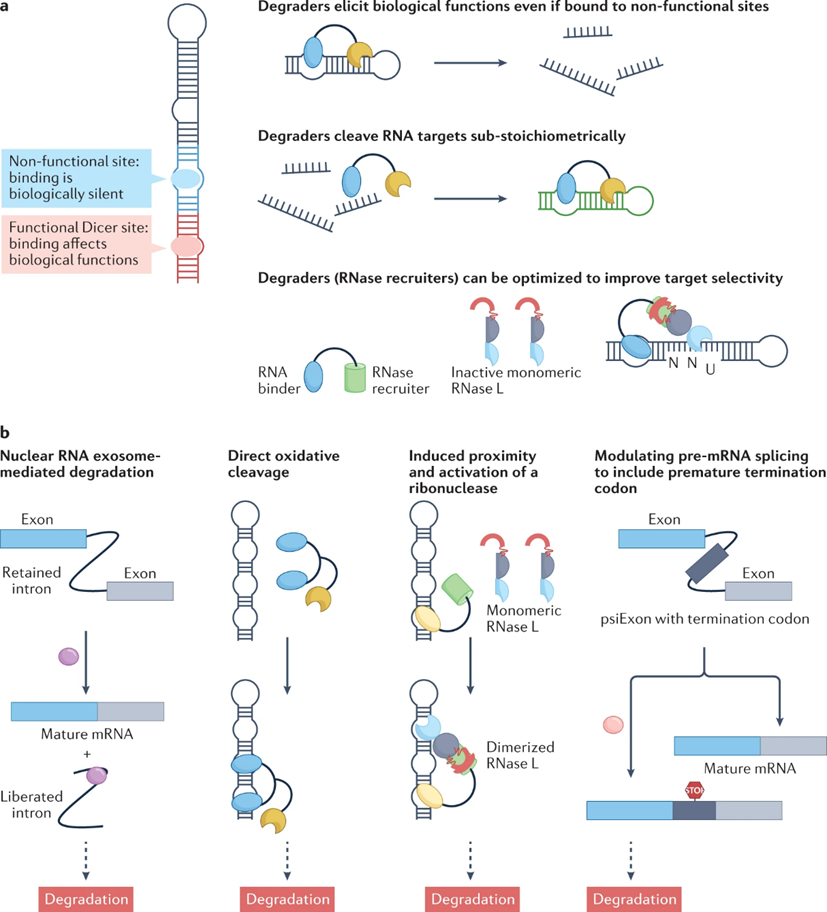
图6:小分子 RNA 降解剂及其作用机制
5.3 靶向RNA相关的通路
▲Ribocil是针对FMN核糖体开关的抗菌剂。核糖体开关是细菌mRNA的5‘先导物中的结构化非编码序列,控制下游ORF的基因表达(图5d)。
▲Risdiplam和branaplam是靶向RNA-蛋白质多样性的小分子,引导pre-mRNA剪接。它们的开发并不是依赖于特定的靶点,而是依赖于所期望的活性。
▲Rocaglamide是一种抑制含有多嘌呤的转录本翻译的分子胶(图5f和表2)。
小分子靶向RNA研究的未来十年
尽管RNA被认为是一个具有挑战性的靶点,但通过结构结合的小分子调节RNA功能在治疗上越来越实用。
小分子结合若不足以产生生物活性。可以使用最近开发的工具确定是否与细胞靶标结合但产生了生物沉默的相互作用。使用Chem-CLIP等方法将靶标占用研究与转录组和蛋白质组范围的研究相关联是一种强大的策略,可以定义靶标和非靶标,并且可发现是否引发不想要的生物反应。有趣的是,片段映射和Chem-CLIP结合RNA结构预测程序,如扫描折叠,可以提供对配体细胞RNA结构的洞察力; 此外,还可通过小分子诱导的降解进行生物沉默靶向作用。
将生物活性小分子从细胞转化为动物,然后再转化为临床,是RNA靶向小分子的一个重要障碍。重要的是将患者组织中的转录组广泛分析纳入临床开发管道,以评估疗效和毒性。这类研究还提供了RNA靶点可接受的选择性范围,可能与蛋白质的选择性范围有很大不同。在体内研究中,人和小鼠RNA序列和结构的显著差异,尤其是非编码RNA,可能会改变化合物的活性或选择性。由于很少有RNA靶向化合物被用于动物研究和临床,因此需要更多数据来定义临床前和临床候选药物的药代动力学和药效学特征。由于PROTACs和其他蛋白靶向药物改变了对传统法则的看法,我们需要坦然面对这样一个事实,即调节RNA功能的小分子的物理化学性质可能超出了传统的类药物空间。
随着RNA在健康和疾病中的功能不断扩大和多样化,RNA化学生物学领域也随之扩大和多样化,证明RNA确实是可由小分子药物捕获的。此外,可以设计RNA靶向的小分子并优化导联,后者使用具有重要修饰和考虑因素的蛋白质靶标开发的策略。随着学术界和工业界推动这一领域的前沿发展,我们相信,未来十年将有更多RNA靶向药物进入临床。

表4:开发靶向 RNA 的小分子疗法的工具和挑战
参考文献:
[1] Childs-Disney, J.L., Yang, X., Gibaut, Q.M.R. et al. Targeting RNA structures with small molecules. Nat Rev Drug Discov 21, 736–762 (2022).
[2] Burma S, Chen BP, Murphy M, Kurimasa A, Chen DJ. ATM phosphorylates histone H2AX in response to DNA double-strand breaks. J. Biol. Chem. 2001;276:42462–42467.
[3] Li Y, Disney MD. Precise small molecule degradation of a noncoding RNA identifies cellular binding sites and modulates an oncogenic phenotype. ACS Chem. Biol. 2018;13:3065–3071.
[4] Liu X, et al. Targeted degradation of the oncogenic microRNA 17-92 cluster by structure-targeting ligands. J. Am. Chem. Soc. 2020;142:6970–6982.
[5] Benhamou RI, et al. Structure-specific cleavage of an RNA repeat expansion with a dimeric small molecule is advantageous over sequence-specific recognition by an oligonucleotide. ACS Chem. Biol. 2020;15:485–493